Cette méthode décrit le prélèvement Actif sur cassette et l'analyse par spectrophotométrie de la (des) substance(s) : Endotoxines
Données de validation : Validation complète
Substances
Informations générales
Propriétés physico-chimiques
| Nom | N° CAS | Formule chimique | Classification CMR |
|---|---|---|---|
| Endotoxines |
|
Plus d'informations
| Nom | Masse molaire | Densité | Synonymes | Fiche toxicologique |
|---|---|---|---|---|
| Endotoxines |
Familles de substances
- AGENTS BIOLOGIQUES
- BIOAEROSOLS
Principe et informations
Les endotoxines sont des lipopolysaccharides (LPS) présents dans la membrane externe des bactéries à Gram négatif. Ce sont des molécules complexes, de poids moléculaire élevé (2 000 à 20 000 daltons), constituées à la fois d‘une partie polysaccharidique et d’une partie lipidique. La partie lipidique, appelée "le lipide A", est responsable des activités toxiques du LPS. La partie polysaccharidique est composée de deux éléments, une partie appelée le "polysaccharide central" (noyau interne et externe) et une partie appelée "chaîne latérale O". La composition chimique du polysaccharide central varie d’une espèce bactérienne à une autre. La "chaîne latérale O" ou "antigène O" est une chaîne polysaccharidique courte directement liée au polysaccharide central. Sa composition varie d’une espèce à une autre mais également au sein d’une même espèce. Le polysaccharide central est responsable des activités antigéniques du LPS.
Les endotoxines peuvent être libérées lors de la croissance et de la lyse cellulaire et être présentes dans les bioaérosols. A l’heure actuelle, il n’existe ni VLEP-8h ni VLEP-CT pour les endotoxines en milieu professionnel. Toutefois, deux valeurs guides ont été établies en 2015 à partir de mesures réalisées dans l’atmosphère de nombreux secteurs professionnels. Les deux valeurs guides retenues sont 200 UE/m3 (valeur au-dessus de laquelle les situations de travail font partie des 20% les plus exposantes) et 1000 UE/m3 (valeur au-dessus de laquelle les situations de travail font partie des 10% les plus exposantes) voir HST n°239.
La méthode de mesure proposée suit en partie les recommandations de la norme NF EN 14031 [1]. Pour mesurer les endotoxines, l’échantillonnage de l’air est effectué par filtration sur filtre en fibres de verre ou sur membrane de collecte en polycarbonate (PC) ou en PTFE à l’aide de cassettes fermées 37mm. Les endotoxines sont extraites dans la cassette par agitation avec de l’eau purifiée stérile et apyrogène, et le dosage des endotoxines dans les extraits est effectué par la méthode au lysat d’amoebocytes de limule (LAL).
Principe de prélèvement et d'analyse
-
État physique
Particules en suspension (liquides ou/et solides) -
Type de prélèvements
Actif -
Nom du dispositif
cassette -
Plus d'informations
-
Technique analytique
SPECTROPHOTOMETRIE
Domaine d'application
| Substance | Quantité minimum sur le dispositif | Quantité maximum sur le dispositif | Concentration minimum | Concentration maximum | Volume maximum |
|---|---|---|---|---|---|
| Endotoxines | 0,05 UE/m3 en conditions de laboratoire
|
10 000 UE/m3 en conditions de laboratoire |
Réactifs
- Eau apyrogène pour LAL (eau LAL)
- Eau purifiée stérile apyrogène (EPSA)
- Endotoxines de référence associées au réactif LAL (ESCHERICHIA COLI 055:B5)
- Réactif LAL lyophilisé
Méthode de prélèvement
Prélèvement des aérosols par cassette fermée
Un dispositif de prélèvement :
Dispositif N°1
-
Type dispositif
CASSETTE 37 mm 3 pièces -
Support ou substrat de collecte
- 1 FILTRE EN FIBRES DE VERRE APYROGENE
-
Préparation du substrat
Le filtre en fibres de verre (support de collecte) doit être préalablement dépyrogénéisé dans une étuve à 250°C pendant 2h.
-
Commentaires, conseils et consignes
Dans le cadre de la détermination des concentrations en endotoxines dans l’air, le filtre de collecte en fibres de verre (FV) peut être remplacé par une membrane de collecte en polycarbonate (PC) Nuclepore (0,8 µm de diamètre de pore) ou une membrane de collecte en PTFE Fluoropore (1,0 µm de diamètre de pore). Aucun traitement n’est à effectuer pour les membranes de collecte PC ou PTFE. Le recours à l’une ou l’autre de ces membranes devra impérativement s’accompagner d’un filtre en fibres de verre apyrogène en tant que support tampon. La présence de ce filtre support en fibres de verre apyrogène permet d’éviter la déformation de la membrane de collecte (PC ou PTFE) et d’assurer une étanchéité satisfaisante dans la cassette lors du prélèvement. Toutes les dispositions concernant l’assemblage et l’étanchéité des cassettes devront être, par ailleurs, respectées et vérifiées.
Le montage de la cassette fermée se fait sous un Poste de Sécurité Microbiologique (PSM). Le filtre en fibres de verre est déposé dans la pièce de sortie de la cassette à l’aide d’une pince préalablement désinfectée. Lorsqu’une membrane PC ou PTFE est utilisée, ce filtre FV servira de support tampon. La cassette est ensuite correctement assemblée de préférence à l’aide d’une presse pneumatique pour assurer l’étanchéité (pression à 2 bars) puis fermée avec des bouchons. Il est recommandé d’utiliser un lot de cassettes dédiées, stockées à température ambiante, à l’abri de la lumière et de la poussière dans un endroit sec.
Conditions de prélèvement
-
Débit de prélèvement (L/min)
2 -
Temps de prélèvement maximum en heures
8 heures -
Particularités, commentaires, conseils
Le prélèvement peut aller de 60 minutes à 8 heures.
Pompe de prélèvement
- Pompe à débit de 1 à 5 L/min compensant les fortes pertes de charges (sup, à 20 pouces d'eau)
Méthode d'analyse
Préparation d'analyse
-
Durée de conservation prélèvements avant analyse
8 jours -
Conditions de conservation avant analyse
Les cassettes prélevées peuvent être conservées 8 jours à température ambiante.
-
Nombre d'étapes de préparation
2 -
Commentaires sur les étapes
Toutes les étapes sont réalisées en conditions aseptiques sous un poste de sécurité microbiologiques (PSM) en évitant toute contamination. Tous les consommables (tubes en verre, embouts de micropipettes, pipettes, seringues) doivent être stériles et apyrogènes. L’usage de tubes en plastique (notamment polypropylène) est fortement déconseillé car ce matériau adsorbe les endotoxines.
2 étapes de préparation :
Étape de préparation N°1
-
Solvant ou solution
- EPSA
-
Type de préparation
Extraction -
Volume
5 mL -
Temps d'agitation
20 min -
Commentaires
Les 5 mL d'EPSA sont introduits par l'orifice supérieur de la cassette à l'aide d'un dispositif à usage unique comme une pipette par exemple. L'agitation de 20 minutes doit être forte, de type agitation orbitale à 2000 rpm.
L’extrait doit être récupéré de manière à éviter toute contamination par exemple en utilisant une seringue à embout Luer Lock (compatible avec l’orifice de la cassette). Pour cela, enlever le bouchon de l’orifice supérieur de la cassette et introduire la seringue (de capacité 5 ou 10 mL). Retourner la cassette, retirer le deuxième bouchon pour faire pénétrer de l’air et aspirer l’extrait. Retirer la seringue et transférer son contenu dans un tube en verre.
Étape de préparation N°2
-
Solvant ou solution
- EPSA
-
Type de préparation
Dilution -
Temps d'agitation
1 min -
Commentaires
Dilutions en cascade au 1/10ème, et agitation forte pendant 1 minute avec par exemple, un vortex réglé à 2000 rpm. Si la vitesse d'agitation est plus faible il conviendra d'agiter pendant 2 minutes.
Les extraits des cassettes doivent être dilués avec de l’EPSA, hormis pour les très faibles concentrations. Les dilutions sont à adapter en fonction de la concentration d’endotoxines contenue dans l’extrait et il est préférable, quand c’est possible, d’analyser deux dilutions successives (par exemple 1/10e et 1/100e).
Une condition analytique :
Condition analytique N°1
-
Technique analytique
- SPECTROPHOTOMETRIE
-
Commentaires, conseils ou condition particulières
Longueur d'onde : 405 nm
Le dosage des endotoxines est effectué avec la méthode cinétique et chromogénique au réactif LAL. Le mode opératoire décrit dans cette fiche reprend les préconisations de la méthode Kinetic-QCL™ (Lonza). D’autres fabricants commercialisent des réactifs similaires. Dans ce cas, il convient d’adapter le protocole car les recommandations peuvent être quelque peu différentes de celles-ci.
Le dosage est réalisé avec un spectrophotomètre thermostaté à 37 °C et adapté pour la lecture des plaques de titration de 96 puits. Ce spectrophotomètre est préférentiellement piloté par un logiciel dédié commercialisé par un fournisseur de réactifs pour le dosage des endotoxines.
Étalonnage et expression des résultats
La réalisation de la courbe d'étalonnage est obligatoire.
-
Principe d'étalonnage
externe -
Solvant de l’étalon
- Eau apyrogène pour dosage LAL commercialisée par le fournisseur de réactif LAL (eau LAL)
-
Commentaires
Le dosage des endotoxines est effectué selon le mode opératoire conseillé par le fabricant de réactif LAL.
Il est effectué sur deux réplicats des échantillons décrits dans le tableau ci-dessous. Dans la majorité des cas, les extraits des cassettes doivent être dilués avec de l’EPSA. Chaque extrait (pur ou dilué) est analysé seul ou en présence d’un ajout dosé (solution d’endotoxines standard) afin de détecter la présence potentielle d’interférents.
Echantillons Description Volume déposé par puits Gamme etalon Eau LAL 0 UE/mL 100µL Solution d'endotoxines standard à
0,005 UE/mL 100 µL 0,05 UE/mL 100 µL 0,5 UE/mL 100 µL 5 UE/mL 100 µL 50 UE/mL 100 µL Extrait de cassette Extrait pur ou dilué 100 µL Extrait de cassette dopé Extrait pur ou dilué + ajout dosé (1/10 e du volume d’extrait) d’une solution d’endotoxines standard (généralement 5 EU/mL mais à adapter en fonction de la concentration d’endotoxines contenue dans l’extrait). 100 µL + 10 µL Contrôle négatif EPSA (eau apyrogène utilisée pour extraire et diluer les extraits de cassettes) 100 µL Contrôle positif Solution d’endotoxines standard à 0,05 EU/mL ou 0,5 EU/mL ou 5 EU/mL 100 µL UE : Unité d'Endotoxines
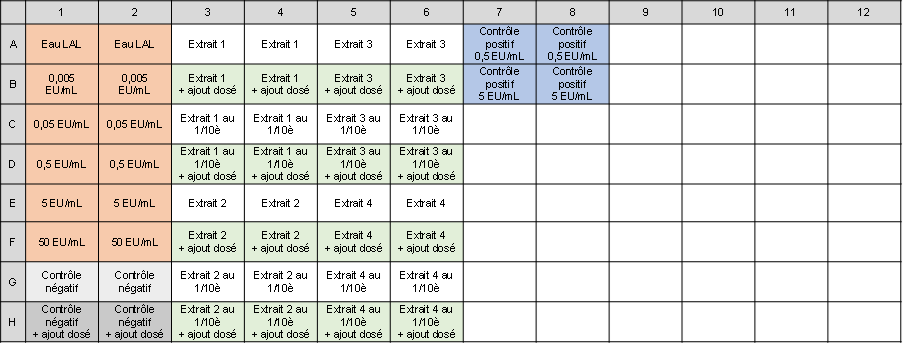
- Etablir le plan de distribution des échantillons dans la plaque de 96 puits et paramétrer le dosage des endotoxines à l’aide d’un logiciel dédié. Un exemple de plan de plaque pour 4 extraits de cassette passés purs et dilués au 1/10e est donné ci-dessous.
- Préparer la gamme étalon à partir d’un flacon d’endotoxines lyophilisées associé au réactif LAL.
Reconstituer le lyophilisat selon les informations figurant sur le certificat d’analyse pour avoir une concentration finale de 50 UE/mL. Puis, procéder par dilutions successives au 1/10e dans de l’eau LAL pour préparer les autres solutions d’endotoxines par exemple:
100 µL à 50 UE/mL + 900 µL eau LAL → 5 UE/mL
100 µL à 5 UE/mL + 900 µL eau LAL→ 0,5 UE/mL
100 µL à 0,5 UE/mL + 900 µL eau LAL → 0,05 UE/mL
100 µL à 0,05 UE/mL + 900 µL eau LAL → 0,005 UE/mL
- Diluer les extraits des cassettes, si nécessaire, par dilutions successives au 1/10e dans de l’EPSA.
- Distribuer les échantillons avec une micropipette et les ajouts dosés avec une pipette à répétition dans une plaque de 96 puits selon le plan de plaque préalablement défini.
- Pré-incuber la plaque, avec son couvercle, dans le spectrophotomètre thermostaté à 37 °C pendant 10 minutes (facultatif).
- Préparer le réactif LAL en reconstituant le lyophilisat avec l’eau pour dosage LAL selon les instructions du fabricant. S’il y a lieu, reconstituer plusieurs flacons de réactif et les regrouper dans un seul contenant.
- Le réactif LAL est distribué dans les puits de la plaque à l’aide d’une pipette à répétition ou d’une pipette multicanaux, à raison de 100µL par puits. La distribution doit être aussi rapide et régulière que possible.
- Incuber la plaque, sans son couvercle, dans le spectrophotomètre. Démarrer immédiatement le pilotage du spectrophotomètre à partir du logiciel.
- Quand le dosage est terminé, le logiciel stoppe l’analyse et calcule la concentration d’endotoxines contenue dans les échantillons.
- Etablir le plan de distribution des échantillons dans la plaque de 96 puits et paramétrer le dosage des endotoxines à l’aide d’un logiciel dédié. Un exemple de plan de plaque pour 4 extraits de cassette passés purs et dilués au 1/10e est donné ci-dessous.
-
Calcul de la quantité de substance sur le dispositif
Le logiciel de pilotage du spectrophotomètre détermine le temps de réaction de chaque échantillon qui correspond au temps nécessaire pour que la densité optique à 405 nm augmente de 0,2 unité.
Interprétation des résultats
- Pour que le test soit valide, la concentration d’endotoxines des contrôles négatifs (eau LAL et EPSA) doit être significativement inférieure à la plus faible concentration d’étalon.
- La droite de régression caractérise la gamme étalon. Le coefficient de corrélation de la courbe d’étalonnage incluse dans le test doit avoir une valeur absolue supérieure ou égale à 0,980 pour que l’essai soit validé. Ces calculs sont effectués par le logiciel dédié.
- La concentration moyenne d’endotoxines mesurée pour les contrôles positifs doit se situer à +/- 25 % de la concentration nominale. Par conséquent, si le contrôle positif contient 0,05 UE/mL, la concentration mesurée doit se situer entre 0,0375 et 0,0625 UE/mL.
- Les concentrations d’endotoxines contenues dans les extraits des cassettes doivent être comprises dans les limites de la gamme étalon (soit entre 0,005 et 50 UE/mL). Les échantillons ayant des concentrations en dehors de la limite basse de la gamme étalon seront rapportés comme inférieurs à 0,005 UE/mL. Si la concentration est trop importante (c’est-à-dire > à 50 UE/mL), il conviendra de repasser l’échantillon en réalisant au moins une dilution supplémentaire au 1/10e.
- Le coefficient de variation calculé pour deux réplicats d’un même échantillon doit être inférieur ou égal à 10 %.
- Dans les échantillons dopés, le recouvrement de l’ajout dosé doit être compris entre 50 et 200 % de la concentration nominale selon le fabricant. Un recouvrement non compris dans ces limites met en évidence une interférence avec le dosage LAL (une inhibition pour un recouvrement inférieur à 50 % et une potentialisation pour un recouvrement supérieur à 200 %).
Pour lever ces interférences, le dosage doit être refait en diluant l’échantillon. Si, malgré tout, l’interférence ne peut être levée, le résultat de l’analyse doit s’accompagner d’un commentaire mentionnant l’interférence.
Calcul de la concentration d’endotoxines dans l’échantillon d’air prélevé
Les résultats sont exprimés en Unités d'Endotoxines par m3 d'air, UE/m3 et calculés de la façon suivante :
E = (e x V0)/V
Avec :
- E : concentration d’endotoxines dans l’échantillon d’air prélevé (UE/ m3)
- e : concentration d’endotoxines dans l’extrait de la cassette (UE/mL)
- Vo : volume de solution d’extraction (mL)
- V : volume d'air prélevé (m3)
V = (Q/1 000) x T
Et :
- Q : débit moyen de la pompe de prélèvement (L/min)
- T : durée du prélèvement (min)
Bibliographie
[1] AFNOR. NF EN 14031 Exposition sur les lieux de travail — Mesure quantitative des endotoxines aéroportées. 2021 :21.
Historique
| Version | Date | Modification(s) faisant l'objet de la nouvelle version |
|---|---|---|
| M-454/V01 | Novembre 2023 | Nouvelle méthode remplaçant la M-154 |
Date de mise à jour : novembre 2023
